Técnicas de Reprodução Assistida : Bebê de Proveta
Reprodução Assistida é o termo utilizado para o conjunto de técnicas para tratamento da infertilidade conjugal que envolvem a manipulação em laboratório de pelo menos um dos gametas: espermatozóides ou óvulos. As técnicas amplamente utilizadas são a inseminação intra-uterina (IIU), a fertilização in vitro (FIV) e a injeção intracitoplasmática de espermatozóides (ICSI). Estes procedimentos podem ser realizados com os gametas do casal ou, em casos de esterilidade ou de transmissão de doenças dominantes, pode-se utilizar espermatozóides de banco de sêmen ou óvulos doados. Ainda não há disponível banco de óvulos.
A legislação em relação às técnicas de reprodução assistida e à doação de gametas é diferente em diferentes países.
Os casais que se submetem a técnicas de reprodução assistida devem ser esclarecidos exaustivamente sobre os procedimentos a que serão submetidos. É conveniente que leiam e assinem consentimentos informados sobre os procedimentos.
Inseminação intra-uterina ou Inseminação Artificial
È a técnica mais simples de reprodução assistida, dita de baixa complexidade. Nela se manipula em laboratório apenas os espermatozóides (gameta masculino).
A inseminação intra-uterina é a colocação dos espermatozóides preparados dentro do útero, sendo que a fertilização (penetração do espermatozóide no óvulo) ocorre no ambiente natural – a trompas.
A inseminação intra-uterina está indicada em casos de fator masculino leve e em infertilidade sem causa aparente (principalmente quando a mulher é jovem). Neste procedimento deve-se ter certeza de que as trompas estão normais, pois elas deverão captar o óvulo, fornecer condições para que ocorra a fertilização (penetração do espermatozóide no óvulo) e transportar o embrião até o útero.
Para inseminação intra-uterina, o parceiro coleta o sêmen por masturbação, e a seguir o sêmen é capacitado (preparado). Preparar ou capacitar o sêmen significa separar os espermatozóides móveis e normais do líquido seminal. Esta capacitação permite muitas vezes que os espermatozóides melhorem seu padrão de movimento, tornando-se mais rápidos e direcionados. Isto é realizado por técnicas de centrifugação e lavagem do sêmen. A figura abaixo ilustra uma das técnicas de capacitação dos espermatozóides.
FIGURA: Uma das técnicas de capacitação espermática. No último tubo estão os espermatozóides capacitados.
Para que a inseminação intra-uterina tenha resultados satisfatórios é necessário que, após o preparo do sêmen, a concentração de espermatozóides móveis e direcionados seja de aproximadamente 10 milhões de espermatozóides móveis e direcionados por ml. Por isto, em casais cujo espermograma está muito alterado este procedimento não é realizado.
Freqüentemente se associa a inseminação intra-uterina à indução da ovulação na mulher. Nestes casos deve se ter o cuidado de controlar o número de óvulos que estão crescendo (com ecografia transvaginal seriada) e que terão possibilidade de ovular. Caso houver mais de três óvulos maduros está aconselhado a suspensão do procedimento pois o risco de gestação múltipla é alto.
A inseminação intra-uterina, colocação dos espermatozóides preparados dentro do útero no período ovulatório, não requer anestesia. Expõe-se o colo do útero com o espéculo e com uma cânula delicada através do orifício do colo injeta-se os espermatozóies capacitados dentro do útero. Após a inseminação os espermatozóides vão em busca do óvulo e a fertilização ocorre nas trompas, in vivo.
O período após a inseminação não requer repouso ou mudança de hábitos (exceto exposição a radiação e medicações) e na maioria das vezes a paciente não utiliza qualquer medicação. Caso atrasar a menstruação (mais de 14 dias após a ovulação ou a inseminação) a paciente fará um teste de gestação.
Esta técnica apresenta em torno de 16% de chance de gestação quando bem indicada. Geralmente não se realiza este procedimento mais de 3 vezes, passando então para a fertilização in vitro.
Espermatozoides capacitados
Inseminação intra- uterina
Ovulação múltipla – a fertilização ocorre in vivo, dentro da trompa
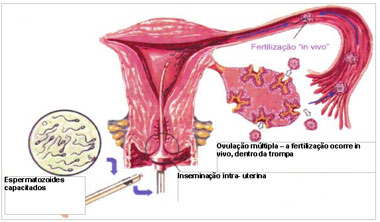
Figura: Inseminação intra-uterina
FERTILIZAÇÃO IN VITRO (FIV)
O nascimento de Louise Brown em 1978, a primeira criança concebida após fertilização in vitro e transferência de embrião marcou o início de uma era de extraordinário progresso no entendimento e tratamento dos problemas relacionados à fertilidade humana.
A fertilização in vitro, denominada „Bebê de Proveta“, deve-se ao fato da fecundação do óvulo pelo espermatozóide ocorrer fora do corpo, em laboratório, ou seja, in vitro.
Originalmente a fertilização in vitro seguida de transferência de embriões (FIV-TE) foi proposta para o tratamento dos casos de infertilidade tubárea, ou seja, para aquelas pacientes em que as trompas estavam ausentes ou irreparavelmente obstruídas. O aprimoramento das técnicas de FIV ampliou as suas indicações e permitiu o seu uso para o tratamento da infertilidade de outras causas. Atualmente se utiliza a fertilização in vitro para tratamento de infertilidade tubária e peritoneal (endometriose grave), fator masculino grave, infertilidade sem causa aparente e naqueles casos em que terapêuticas mais simples não resultaram em gestação. Sempre que a idade da mulher for maior que 35 anos se é mais liberal na indicação desta técnica.
A Injeção intracitoplasmática de espermatozóides – ICSI é uma técnica de reprodução assistida onde a fertilização também ocorre in vitro, entretanto não ocorre espontaneamente, ou seja, os espermatozóides são colocados dentro do óvulo para que ocorra a fertilização. Esta técnica teve seu primeiro relato de gestação e nascimento em 1992 e foi, sem dúvida, o maior avanço no tratamento da infertilidade na após a fertilização in vitro clássica.
Sempre que falamos em FIV estamos nos referindo a técnica em que o espermatozóide entra “por suas próprias forças” para dentro do óvulo (a fecundação ocorre in vitro e o melhor espermatozóide penetra o óvulo, sem auxílio), quando falamos em ICSI a fertilização também ocorre fora do corpo e o espermatozóide é colocado com auxilio de uma pipeta injetora dentro do óvulo (auxiliamos a fecundação). FIV e ICSI são denominados procedimentos de alta complexidade em reprodução assistida.
As etapas envolvidas em um ciclo com fertilização in vitro são as seguintes:
| indução da ovulação, | |
| aspiração folicular, | |
| fecundação in vitro e | |
| transferência embrionária. |
Apenas a etapa fecundação in vitro é diferente entre a FIV e a ICSI.
1. Indução da ovulação e controle ecográfico do crescimento folicular:
Induzir a ovulação para fertilização in vitro significa utilizar medicações hormonais com o
objetivo de fazer crescer e amadurecer mais folículos do que em um ciclo espontâneo.
Normalmente, a mulher ovula apenas um óvulo a cada ciclo, se utilizássemos o ciclo natural
teríamos em cada ciclo apenas um óvulo crescendo e teríamos, se todas as etapas tivessem
100% de sucesso, apenas um embrião para transferência ao útero materno. Com a indução da
ovulação fazemos com que “amadureçam” mais óvulos a cada ciclo aumentando a
probabilidade de termos mais embriões. Transferindo mais de um embrião aumentamos a
chance de gestação, embora aumente significativamente a probabilidade de gestação múltipla.
O crescimento folicular é controlado por ecografias transvaginais quase diárias a partir do
oitavo dia do ciclo. Quando pelo menos dois folículos atingem um diâmetro ecográfico de 18 a
20 mm, geralmente entre o 10º e o 14º dia do ciclo induzido, programa-se a aspiração
folicular.
O adequado controle ecográfico da ovulação, além de avaliar o crescimento dos folículos
ovarianos acompanha a proliferação endometrial. O endométrio (tecido que reveste a cavidade
uterina) é o local onde os embriões serão transferidos. No início do ciclo menstrual ele tem
espessura de até 0,5 cm e no período ovulatório chega a 1 cm. Este tecido é preparado pelos
hormônios ovarianos para oferecer condições necessárias para que os embriões se implantem
permitindo a gestação.
Caso o endométrio não apresente as condições ideais, diminuem as chances de gestação.
Existem diversos esquemas de indução de ovulação. A medicação é escolhida segundo as
características clínicas e laboratoriais das pacientes (idade, peso, regularidade do ciclo
menstrual, valor basal do hormônio FSH, etc). A resposta aos medicamentos é característica de
cada mulher. Mulheres mais jovens, geralmente, necessitam menos medicações para a
produção do crescimento de vários folículos. Denomina-se pacientes má-respondedoras
aquelas que, apesar de usarem medicações adequadas, não apresentam crescimento de
múltiplos folículos, sendo captados poucos ou nenhum óvulo.
Mulheres com resposta ovariana adequada à indução têm maiores chances de gestação,
pois a captação de mais de 4 óvulos é correlacionada com melhores resultados.
Citrato de Clomifene
O citrato de clomifene (CLOMID®, SEROFENE®, INDUX®) é um indutor da ovulação de
uso por via oral. Sua ação central antiestrogênica provoca aumento dos níveis de FSH e LH
secretados pela hipófise, melhorando o recrutamento folicular.
Esta medicação é mais utilizada para a indução da ovulação para inseminação intra-
uterina, quando o objetivo é a ovulação de no máximo 3 óvulos. É o indutor de ovulação mais
antigo, mais barato e ativo por via oral.
Quando os folículos atingirem, à ecografia transvaginal, 20 mm aproximadamente, eles
serão considerados maduros, podendo ser utilizado o HCG (Profasi®, Pregnil®, Ovidrel®) para
a maturação final e liberação do óvulo.
Gonadotrofinas
As gonadotrofinas podem ser derivadas de urina de mulheres menopausadas (Pergonal®,
Humegon®, Metrodin®, Choragon®, Menogon®) e, mais recentemente, o FSH (Puregon® e
Gonal F®) e o LH (Luveris®) recombinantes, sintetizados por engenharia genética. As
gonadotrofinas têm custo elevado, e são de uso subcutâneo ou intramuscular.
As gonadotrofinas estimulam o crescimento de múltiplos folículos, seu uso é iniciado no
2º ou 3º dia do ciclo. Podem ser utilizadas doses constantes ou variáveis, em diversos
esquemas de indução. O crescimento folicular é acompanhado com ecografia transvaginal
seriada.
Quando no mínimo 2 folículos atingem a ecografia transvaginal aproximadamente em 18
mm eles são considerados maduros, sendo então utilizado o HCG (Profasi®, Pregnil®,
Choragon®, Ovidrel®) para maturação final e liberação do óvulo.
Trinta e seis horas após a injeção do HCG, programa-se a captação de óvulos sob
controle ecográfico.
Análogos do GnRH
O uso de análogos do GnRH (uso subcutâneo ou intranasal), associado as gonadotrofinas,
trouxe duas vantagens principais para indução da ovulação no processo FIV-TE: acentuada
redução do risco de descarga prematura de LH (evita que ocorra a ovulação antes da hora
programada) e facilidade de manipulação do ciclo pela equipe médica.
Os agonistas do GnRH promovem, inicialmente, o esvaziamento do LH e FSH da hipófise.
Após, com uso continuado dos agonistas, ocorre queda paulatina da secreção de
gonadotrofinas, que permanecem em níveis baixos e com pouca atividade biológica. Os
agonistas podem ser utilizados antes da menstruação ou no segundo dia do ciclo, dependendo
do esquema utilizado pelo médico.
O agonista é mantido durante toda a maturação folicular (fase de crescimento dos
folículos) até o momento da aplicação do HCG (medicamento utilizado para induzir a
maturação final e ruptura dos folículos).
Antagonista do GnRH
São medicações que bloqueiam a liberação de LH e de FSH pela hipófise. São utilizados
para evitar a liberação do LH hipofisário, o que acarretaria ruptura folicular precoce e
suspensão do ciclo. Também são de uso subcutâneo.
Aspiração Folicular
É a punção por via transvaginal dos folículos ovarianos. Adapta-se uma agulha no
transdutor vaginal do ecógrafo e com ela, através da parede vaginal, se aspira o líquido
folicular, onde o óvulo está “boiando”. Este procedimento é realizado com a paciente sedada,
para que não sinta dor.
Após a coleta de óvulos, a paciente permanece em repouso até se recuperar da sedação e,
geralmente, poderá em algumas horas exercer suas atividades. Depois da aspiração folicular, a
paciente pode sentir uma leve dor abdominal, geralmente resolvida com analgésicos comuns, e
desaparecendo no decorrer do dia. Também pode haver sangramento vaginal discreto. Febre,
dor aguda ou sangramento excessivo sempre devem ser comunicados ao médico.
O líquido de cada folículo ovariano puncionado é imediatamente encaminhado ao laboratório,
onde o embriologista, através de um estereomicroscópio, localiza os óvulos e os coloca em
meio de cultura. Todo o procedimento é realizado em ambiente extremamente limpo e com
uma série de cuidados em relação à pureza do ar. Os óvulos são manipulados rapidamente,
sempre sob placas aquecidas, para que não sofram variações importantes de temperatura. A
luminosidade do laboratório também é controlada. Os óvulos e embriões humanos são
sensíveis à variações de temperatura, pH, luminosidade, pureza do ar, etc.

Fecundação in vitro
A)Fertilização in vitro -FIV :
O sêmen é coletado por masturbação, e preparado da mesma forma que para
inseminação intra-uterina.
Os óvulos ficam algum tempo em cultura (4 a 6 horas) e, após, são inseminados in vitro, ou
seja, os espermatozóides são colocados na placa de cultura junto com os óvulos, em uma
proporção aproximada de 100.000 espermatozóides para cada óvulo. As placas retornam a
estufa e só serão observadas 16 a 19 horas após para identificar se houve fertilização
(penetração do espermatozóide no óvulo).

Os óvulos inseminados são observados pelo embriologista para averiguar se houve fertilização
normal ou não. Aproximadamente, de 25 a 29 horas após a inseminação os pré-embriões
serão observados para identificar os que se dividiram precocemente. Embriões com divisão
precoce têm maior potencial para a implantação, e deverão estar entre os escolhidos para a
transferência.
B) Injeção Intracitoplasmática de Espermatozóides – ICSI
A ICSI é uma técnica de reprodução assistida, em que a fertilização também ocorre in
vitro; entretanto, não ocorre espontaneamente, ou seja, os espermatozóides são colocados
dentro do óvulo para que ocorra a fertilização. Esta técnica teve seu primeiro relato de
gestação e nascimento em 1992 e foi, sem dúvida, o maior avanço no tratamento da
infertilidade, após a fertilização in vitro clássica.
O sucesso da FIV depende da presença de um número mínimo de espermatozóides com
boa motilidade e morfologia. Homens com número menor do que 1 milhão de espermatozóides
por ml, com motilidade limitada e menos do que 14% de espermatozóides com forma normal
têm pouca chance de fertilização na FIV convencional. A ICSI veio solucionar os casos de
infertilidade por fator masculino grave. O dito popular “para engravidar só precisa de um
espermatozóide” só é válido quando o procedimento é a ICSI.
As indicações para ICSI, além dos casos de fator masculino, são casais com falha e
fertilização na FIV clássica (mesmo sendo os parâmetros do sêmen normais). Esta técnica
permite o uso de espermatozóides aspirados do epidídimo, do testículo e até coletados de
amostra de tecido testicular congelado nos casos de tumores de testículo, de vasectomia,
agenesia de ducto deferente, etc.
Quando está indicada a ICSI, os procedimentos de indução da ovulação, captação de
óvulos e posterior transferência de embriões são idênticos aos da FIV convencional. A
fertilização entretanto é diferente. Os óvulos coletados são identificados pelo embriologista
através de um estereomicroscópio e, após um período de incubação em meio de cultura
especial, eles são desnudados (retiram-se as células da granulosa que envolvem o óvulo com
um líquido especial e pipetação). Os óvulos são classificados e apenas óvulos maduros poderão
ser injetados.
O preparo do sêmen é similar ao procedimento de FIV, exceto nos casos de azoospermia.
Denomina-se:
| PESA – a aspiração percutânea (através da pele) de espermatozóides do epidídimo, | |
| TESA – a aspiração percutânea de espematozóides do testículo e | |
| TESE – a extração de tecido testicular por biópsia, com posterior dissecção do tecido para identificação de espermatozóides. |
Todos estes procedimentos têm por objetivo selecionar espermatozóides vivos para
realização da injeção intracitoplasmática. As taxas de fecundação e de gestação variam de
acordo com o local de onde são retirados os espermatozóides.
A decisão de recuperar os espermatozóides do testículo ou do epidídimo depende da
causa da azoospermia. Em casos de obstrução epididimária ou agenesia de ducto deferente,
utiliza-se a punção de epidídimo. Nos casos de fatores testiculares, a alternativa é a punção
biópsia testicular; nesses casos, os espermatozóides podem demorar para adquirir motilidade.
No procedimento de ICSI propriamente dito, o espermatozóide selecionado é imobilizado
pela pressão da pipeta injetora sobre a sua cauda, sendo então aspirado (pela cauda) para
dentro da pipeta injetora. A pipeta de sucção fixa o óvulo e a pipeta injetora, já carregada com
o espermatozóide, penetra no óvulo. Realiza-se uma discreta aspiração para confirmar que a
membrana do óvulo foi mesmo rompida e, então, o espermatozóide é colocado no citoplasma
do óvulo.
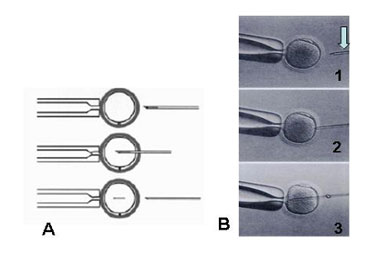
A transferência dos pré-embriões obtidos mediante ICSI ocorre da mesma forma que na
fertilização in vitro convencional.
4.Transferência de embriões:
A transferência é um procedimento relativamente simples, que não necessita sedação. A
mulher deve estar com a bexiga cheia, isto retifica o útero (das mulheres com útero de
curvatura anterior) e facilita o controle ecográfico da transferência dos embriões. A paciente
fica em posição ginecológica, coloca-se o espéculo, e lava-se a vagina com soro fisiológico ou
meio de cultura. Os pré-embriões selecionados para transferência são aspirados em um cateter
muito fino, com mínima quantidade de líquido. A seguir, o cateter “carregado” é passado
através do orifício cervical externo e interno, e os pré-embriões transferidos para o
endométrio, conforme figura abaixo.
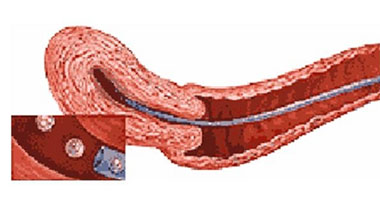
Os pré-embriões, geralmente, são transferidos para o útero materno no período de 48 a
72 horas após a punção. Eles estarão com 4 a 8 células. Nesta etapa, a regularidade dos
blastômeros (cada célula do pré-embrião é denominada blastômero), e a presença de
fragmentação são os critérios mais utilizados para selecionar os embriões que serão
transferidos. Em casos especiais, pode-se optar pela transferência no 5º dia, em estágio de
blastocisto.
A legislação brasileira permite que se transfiram, no máximo, quatro embriões.
Atualmente, transfere-se cada vez menos embriões, principalmente em mulheres jovens e com
embriões com alto potencial de implantação, para diminuir as gestações múltiplas.
Depois da transferência, a paciente pode ficar alguns minutos em repouso. Recomenda-
se que faça repouso relativo por 2 dias após a transferência (pelo que se estudou até agora, o
repouso não tem qualquer significado sobre as taxas de gestação).
A dosagem do -HCG (hormônio produzido pelo embrião) é realizada no 14º dia após a
punção de óvulo, ou no 12º, após a transferência dos embriões, para que assim se faça o
diagnóstico da gestação. Sete a dez dias após o resultado do teste de gestação positivo,
realiza-se uma ecografia transvaginal para identificação de saco gestacional intra-uterino e
embrião. Após comprovação da gestação viável (embrião com batimentos cardíacos) as taxas
de abortamento são similares aquelas de gestações obtidas sem procedimentos de reprodução
assistida.
Taxa de sucesso após fertilização in vitro e ICSI
As chances de gestação dos procedimentos de reprodução assistida estão em parte
determinados pelos equipamentos e profissionais do centro. Entretanto, os fatores independentes que mais
afetam as taxas de sucesso são o número de embriões que se transfere ao útero (tabela) e a
idade da mulher (tabela).
Aproximadamente, 15% das pacientes têm abortamento, o que não parece estar aumentado
em relação as gestações espontâneas.
Nas tabelas abaixo, estão os dados do registro latino americano de reprodução assistida,
mostrando a taxa de nascidos vivos por ciclo de aspiração folicular e por transferência
embrionária, segundo o número de embriões transferidos e a idade da mulher nos
procedimentos de reprodução assistida de alta complexidade.

Tabela: Taxa de gestação clínica de acordo com o número de embriões transferidos em procedimentos de fertilização in vitro (modificada da Red Latinoamericana de Reprodução Assistida 2003).
Tabela: Taxa de gestação clínica de acordo com a idade da mulher em procedimentos de Fertilização in vitro
(modificada da Red Latinoamericana de Reprodução Assistida 2003).
Razões para suspensão de ciclo de reprodução assistida:
Os ciclos de reprodução assistida podem ser suspensos; isto significa que, por algum
motivo, não serão realizadas todas as etapas: indução da ovulação, aspiração folicular,
fecundação in vitro e transferência embrionária. Entre os motivos para suspensão do ciclo
estão a falha de resposta à indução da ovulação (não desenvolvimento de folículos),
aparecimento de cistos ovarianos, ruptura prematura dos folículos, cônjuge não conseguir
coletar o sêmen, não haver fecundação in vitro, etc.
Complicações mais freqüentes nos procedimentos de reprodução assistida:
Maternas
Hiperestimulação ovariana:
É uma resposta exagerada do ovário à estimulação da ovulação, em que o número de
folículos em crescimento é maior que o desejado. Caracteriza-se pelo aumento do tamanho dos
ovários e distensão abdominal devido à retenção de líquidos. Nos casos mais graves, sintomas
como náusea, vômitos, dificuldade respiratória, acúmulo de liquido dentro do abdômen,
ausência de diurese pode ocorrer, e a paciente deve ser hospitalizada. Felizmente, apenas 1%
dos casos necessitam internação.
Esta probabilidade encontra-se aumentada em mulheres jovens com síndrome dos
ovários policísticos.
Gravidez Tubária:
É a implantação do embrião fora da cavidade uterina, mais comumente na trompa.
Este diagnóstico pode ser feito ao redor de 21 dias após a transferência embrionária
quando, por ecografia, pode-se visualizar o saco gestacional (sinal inicial de gestação). Esta
complicação ocorre em torno de 1 a 2% das gestações espontâneas; em ciclos de FIV, a
incidência aumenta para 4%, provavelmente devido à ocorrência de patologias tubárias e
uterinas pré-existentes.
Torção ovariana:
O ovário hiperestimulado pode duplicar ou triplicar de tamanho. O peso aumenta, e a
distensão abdominal (aumento do volume do abdômen) pode facilitar sua torção,
estrangulando o sistema vascular, e originando dores tipo cólica. Se o quadro não se resolve
espontaneamente, poderá ocorrer necrose (morte celular) e, conseqüentemente,
hemorragia ovariana (sangramento dentro do abdômen). Esta é uma emergência médica
que requer solução imediata. Felizmente, ocorre em menos de 1% dos casos.
Outras complicações:
Poderão ocorrer complicações no local da punção transvaginal durante a aspiração
folicular, ainda que de baixa freqüência, sangramento por lesão da parede vaginal, infecção
pélvica , abscesso tubário e, finalmente, lesões de estruturas vizinhas tais como
intestino,bexiga, uretra e grandes vasos.
Defeitos de nascimento:
A porcentagem de malformações dos recém-nascidos, produtos das técnicas de
fertilização in vitro, não é maior que a da população em geral, tanto mundiais ou
americanas (2 a 2,4 % dos examinados).
Em casos de fator masculino grave, realizada a ICSI, em que não ocorre a “seleção
natural” para penetração do espermatozóide, devemos considerar que podemos estar
transferindo problemas genéticos a descendência. Quando existe azoospermia, quase 12%
dos espermatozóides têm alterações genéticas; quando a espermatogênese é normal, a
porcentagem é menor do que 0,5%.
Gravidez múltipla:
A proporção de multigestação é conseqüência direta do número de embriões transferidos
(tabela) e da idade da mulher. A taxa global de multigestação é de 29% . Isso significa que de
100 gestações, 29 apresentam dois ou mais sacos gestacionais e destes, 10% serão reduzidos,
espontaneamente, para somente um saco gestacional, evento que ocorre, habitualmente,
antes da 12º semana de gestação.
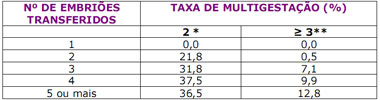
Tabela: Taxa de gestação múltipla, de acordo com a idade da mulher em procedimentos de Reprodução Assistida
(modificada da Red Latinoamericana de Reprodução Assistida 2003).
· 2 Sacos gestacionais (gêmeos) * 3 ou mais sacos gestacionais (trigêmios ou mais)
Dependendo do acesso a centros hospitalares adequados e das condições físicas da paciente, o
desenrolar da gestação gemelar para a mãe e o bebê não deve trazer grandes diferenças em
relação às gestações únicas. As gestações triplas e quádruplas associam-se à maiores taxas de
abortos, mortes fetais, partos prematuros e maior morbimortalidade neonatal.
Segundo dados da Rede Latinoamericana de Reprodução Assistida, a taxa de
prematuridade extrema (nascimento com menos de 31 semanas) é de 3,4% para gestações
únicas, 18,5% para gemelares, 34% para trigêmeos e 42,5 % para quadrigêmeos.
A prematuridade e as complicações neonatais determinam, em muitos casos, seqüelas
permanentes e graves para os nascidos de gestações triplas ou mais. A única maneira de
diminuir a taxa de multigestação é diminuindo o número de embriões a transferir, ocasionando
impacto nas taxas de gestações. Este assunto deve ser discutido entre a equipe de
profissionais e o casal.
O objetivo dos tratamentos em reprodução assistida é sempre a gestação única.
Atualmente, com a melhoria dos laboratórios de fertilização in vitro existe uma tendência à
transferência de 2 a 3 embriões. Existem alguns grupos que preconizam a transferência de
apenas um embrião – muito bem selecionado havendo, então, taxas muito baixas de
gemelaridade.
Embriões Excedentes: O que fazer?
No início de um tratamento de Fertilização in vitro, uma questão bastante importante
para ser discutida com os casais diz respeito ao número de óvulos que, potencialmente, serão
produzidos durante o ciclo. Este número está diretamente relacionado ao número de embriões
que serão obtidos. Um número maior de embriões produzidos permite a escolha daqueles que,
potencialmente, têm melhores condições para implantação, aumentando as chances de
sucesso. Entretanto freqüentemente sobram embriões de boa qualidade, que podem ser
congelados e transferidos em outro ciclo. O congelamento de embriões nada mais é do que a
tentativa de aumentar as chances de gestação de um único ciclo de estimulação ovariana.
Antes da criopreservação de embriões, a mulher que produzia muitos óvulos tinha apenas
alguns óvulos fertilizados ou corria o risco de ter vários embriões descartados (não
transferidos), porque, no máximo, 3 ou 4 embriões podiam ser transferidos para o útero com
segurança. Atualmente, existem protocolos de congelamento de embriões com chance real de
gestação após descongelamento. Provavelmente, em breve possamos obter com embriões
congelados taxas de gestação similares àquelas de embriões frescos.
Segundo o Conselho Federal de Medicina, atualmente os embriões excedentes aos ciclos
de Fertilização in vitro podem ter três destinos: congelamento, doação a outro casal ou doação
para pesquisa com células tronco. A maioria dos casais opta pelo congelamento. Quanto ao
tempo que embriões podem ficar congelados é muito discutido. Já existem relatos de
gestações com nascimento de bebês saudáveis com mais de 10 anos de congelamento.
